ARTÍCULO ORIGINAL
Sistema documental para la conducción de ensayos clínicos oncológicos en la atención primaria de salud
Documentary system for the conduction of Oncologic Clinical Trials in the Primary Health Care´s Level
Geidy Lorenzo Monteagudo,I Olga Torres Gemeil,I Meylan Cepeda Portales,I Maritza Artiles Morales,II María Cecilia Granela,III Ramón Alberto Ortiz Carrodeguas,IV Migdalia Rodríguez Rivas,V Zoe Castañeda Cancio,VI Lizet Sánchez ValdezI
I Centro
de Inmunología Molecular. Siboney, Playa, La Habana, Cuba.
II Policlínico
"XX Aniversario". Santa Clara, Villa Clara, Cuba.
III
Policlínico "Roberto Fleites". Santa Clara, Villa Clara, Cuba.
IV
Hospital "Celestino Hernández Robau". Santa Clara, Villa Clara, Cuba.
V Centro
Nacional Coordinador de Ensayos Clínicos. Playa, La Habana, Cuba.
VI
Universidad Central de Las Villas. Santa Clara, Villa Clara, Cuba.
RESUMEN
Introducción:
En el año 2009, el Centro de Inmunología Molecular comenzó la
conducción de ensayos clínicos en la atención primaria de salud,
por lo que se hizo necesario contar con procedimientos para estandarizar los
procesos ejecutados en este nuevo escenario.
Objetivo:
Elaborar un sistema documental para la conducción de ensayos clínicos
en la atención primaria de salud en Cuba, teniendo en cuenta las características
del sistema sanitario cubano.
Métodos:
Se realizó una investigación de intervención en sistemas y servicios,
en los ensayos clínicos conducidos por el Centro de Inmunología Molecular,
en instituciones de la atención primaria salud de todas las provincias
del país, desde el mes de marzo de 2015 a junio de 2016. Para el análisis
y elaboración del sistema documental, se utilizaron los aspectos comunes
de metodologías descritas en la literatura, acerca de sistemas documentales
según las normas ISO 9001, de 2015. Se utilizó el proceso de consenso
como sistemática de trabajo para la elaboración de los documentos.
Se evaluó la aceptabilidad del sistema en 8 provincias del país.
Resultados:
Se elaboró el mapa de procesos para la conducción de ensayos clínicos
en la atención primaria salud de salud. Se elaboraron siete procedimientos
normalizados de trabajo, tres instructivos y trece registros. Se obtuvieron
valores de aceptabilidad superiores a 6,80 para todos los ítems evaluados,
por lo que la aceptabilidad se consideró de "Bien".
Conclusiones:
Las diferencias en la ejecución de los procesos de ensayos clínicos
en instituciones de la atención primaria de salud con relación a la
atención secundaria, justifican la necesidad de implementación de
un nuevo sistema documental para estandarizar los procesos en este escenario.
Los procedimientos elaborados mostraron buenos niveles de aceptabilidad entre
los profesionales y técnicos que harán uso de los documentos. Su implementación
contribuirá a lograr la estandarización de los procesos en estas instituciones,
así como a una mejor recolección y trazabilidad de los datos en estas
investigaciones.
Palabras Clave: ensayos clínicos; oncología; atención primaria de salud; sistema documental; calidad.
ABSTRACT
Introduction:
In 2009, the Molecular Immunology´s Center started the conduction of clinical
trials in the Primary Health Care´s Level, and in this way it became necessary
to have procedures to standardize the processes executed in this new scenario.
Objective:
To develop a documentary system for conducting clinical trials in the Primary
Health Care´s Level in Cuba taking into account the characteristics of
the Cuban health´s system.
Methods:
An intervention´s research in systems and services of the conducted clinical
trials was carried out by the Center of Molecular Immunology in Primary Care
Health institutions in all provinces of the country from March 2015 to June
2016. For the analysis and elaboration of the documentary system, it were used
the common aspects of methodologies about documentary systems described in literature
according to ISO 9001, 2015 standards. Consensus process was used as a working
system for the elaboration of documents. The acceptability of the system was
evaluated in eight provinces of the country.
Results:
Process Map for conducting clinical trials in the Primary Health Care was developed.
Seven standard processes of work, three instructions and 13 records were developed.
Acceptability values greater than 6.80 for all items evaluated
were obtained in the study, so acceptability is classified as "Good".
Conclusions:
The differences in the execution of clinical trials processes in Primary Health
Care institutions in relation to Secondary Care, justify the need to implement
a new documentary system to standardize processes in this scenario. The procedures
developed showed good levels of acceptability among professionals and technicians
who will use the documents. Its implementation will contribute to achieving
the standardization of the processes in these institutions, as well as to a
better collection and traceability of the data in these investigations.
Keywords: clinical trials; oncology; primary health care; documentary system; quality.
INTRODUCCIÓN
Los ensayos clínicos (EC) son investigaciones que se realizan en seres humanos para evaluar la eficacia y seguridad de productos en investigación, por lo que constituyen estudios indispensables dentro del proceso de desarrollo de nuevos fármacos, cuya ejecución debe cumplir con altos estándares de calidad científica y ética.1,2
Desde el punto de vista regulatorio, existen normas que dictan los principios que deben ser observados para cumplir con estos estándares de calidad y se conocen como buenas prácticas clínicas (BPC). Estas normas establecen las responsabilidades de cada una de las partes implicadas en la ejecución de los EC, Comités de Ética de la Investigación (CEI), investigador, institución y promotor.3-5
Atendiendo a los procesos de control y garantía de la calidad, las BPC establecen que el Promotor es el encargado de instaurar y mantener sistemas de aseguramiento de calidad, con Procedimientos Normalizados de Operación (PNO) escritos, a fin de asegurar que la realización de los ensayos, así como la generación, documentación y comunicación de los datos, cumplan con lo establecido en el protocolo, las BPC y los requisitos reguladores vigentes.3-5
El Centro de Inmunología Molecular (CIM) es un centro promotor perteneciente a la industria biotecnológica cubana, dedicado fundamentalmente, a la obtención de vacunas terapéuticas y de anticuerpos monoclonales para el diagnóstico y tratamiento del cáncer, así como para otras enfermedades relacionadas con el sistema inmune. En sus más de 20 años de trabajo, ha acumulado una amplia experiencia en la conducción de EC que aplican BPC tanto en Cuba, como a nivel internacional. Para lograr estos resultados, se ha contado con un Programa de Aseguramiento de la Calidad de EC y un sistema logístico de BPC, conformado por una serie de PNO, como parte de la llamada Carpeta del Puesto de Trabajo del CIM. Entre estos PNO, se encuentran 64 que guían la conducción de EC en los sitios de investigación pertenecientes a la atención secundaria de salud (ASS), único escenario donde el CIM conducía EC hasta este momento. En el año 2003, esta Carpeta del Puesto de Trabajo fue entregada a todas las instituciones del país involucradas en EC con productos del CIM, lo cual contribuyó a la estandarización de procesos incluidos en las investigaciones clínicas de este contexto.
A partir del año 2009, el CIM comenzó a ejecutar sus EC en los policlínicos docentes comunitarios, instituciones pertenecientes al sistema de la atención primaria de salud (APS), el cual difiere de la atención secundaria de salud (ASS) en cuanto a los objetivos y al nivel de complejidad de las instituciones que lo integran, por lo que los procesos se realizan de forma diferente. Este hecho hizo valorar la necesidad de elaborar nuevos procedimientos que respondieran a las características de este nuevo contexto. Por ello, este trabajo tuvo como objetivo elaborar un sistema documental para la conducción de ensayos clínicos oncológicos en la atención primaria de salud en Cuba, teniendo en cuenta las características del sistema sanitario cubano.
MÉTODOS
Se realizó una investigación de intervención en sistemas y servicios, en los EC conducidos por el CIM en instituciones de atención primaria salud del país, desde marzo de 2015 hasta agosto de 2016. Para el análisis e implementación del sistema documental se utilizaron los aspectos comunes de las metodologías descritas en la literatura acerca de sistemas documentales según las normas ISO 9001, 2015.6 El estudio se diseñó en cuatro etapas, las dos primeras tuvieron lugar durante la fase I y las dos restantes durante la fase II del estudio. Se consideró como universo de estudio a todos los procesos involucrados en la conducción de los EC oncológicos con productos del CIM ejecutados en instituciones de la APS del país; y como muestra, todos los procesos involucrados en la conducción de los EC oncológicos con productos del CIM ejecutados en instituciones de la APS de la provincia Villa Clara.
FASE I DEL ESTUDIO: DIAGNÓSTICO
Etapa 1. Determinación de las necesidades de documentación
Se definieron los procesos y subprocesos que integran el sistema de ensayos clínicos en la APS, con el fin de elaborar su mapa de procesos. Se determinaron los procesos y subprocesos que requerían de la elaboración de PNO o instructivos para ser estandarizados.
Etapa 2. Diagnóstico de la situación de la documentación
Se compararon los sistemas de APS y ASS, atendiendo a las características de la ejecución de los procesos implicados en la conducción de EC. Se realizó la revisión de los principales documentos que regulan la práctica médica en la APS: el programa del Médico y la Enfermera de la Familia,7 el Manual de Organización del Policlínico y la Regulación MINSAP No. 40, del año 2014.8
Por otra parte, se revisaron la Carpeta del Puesto de Trabajo del CIM, el sistema documental del Centro Nacional Coordinador de EC (CENCEC) y el sistema de PNO del Hospital "Celestino Hernández Robau", con vistas a determinar aspectos tales como la existencia de los documentos, la concordancia de estos con el proceso que describen y su exactitud.
Se tuvieron en cuenta, además, las experiencias adquiridas en la conducción de tres EC oncológicos en los policlínicos docentes comunitarios de diferentes provincias del país.
FASE II DEL ESTUDIO: ELABORACIÓN DEL SISTEMA DOCUMENTAL
La fase II fue de intervención y durante esta se elaboraron los PNO, instructivos y registros que conforman el sistema documental para la conducción de EC oncológicos en la atención primaria de salud.
Etapa 3. Elaboración de los documentos
La primera versión de los documentos fue elaborada por especialistas del CIM, con experiencia de más de cinco años de trabajo en investigaciones de este tipo. Se utilizó el proceso de consenso como sistema de trabajo, para lo cual se establecieron dos niveles de consulta.
El primer nivel de consenso o consenso interno se estableció con profesionales vinculados directamente a la asistencia, procedentes de la APS y la ASS del municipio Santa Clara, así como especialistas del CENCEC de la provincia. Este consenso tuvo lugar en una reunión presencial donde se utilizó como técnica la Tormenta de ideas. En dicho contacto se expusieron los criterios sobre los documentos elaborados y se definieron los investigadores que se incorporarían a la elaboración de la segunda versión de estos, de conjunto con los especialistas del CIM. El equipo de trabajo quedó conformado por dos especialistas del CIM y dos médicos especialistas en Medicina General Integral (MGI), además de un oncólogo clínico, una enfermera, un farmacéutico, un imagenólogo y un especialista en laboratorio clínico. Este equipo de trabajo fue capacitado en dos sesiones de trabajo subsiguientes.
Una vez elaborada la segunda versión de los procedimientos, tuvo lugar el segundo nivel de consenso o consenso externo, el cual se estableció con la participación de especialistas y técnicos implicados en la conducción de EC procedentes de todos los policlínicos de la provincia Villa Clara (directores de policlínicos, médicos especialistas en MGI, enfermeros, farmacéuticos, especialistas en laboratorio clínico y especialistas en imagenología), de la oficina nacional del CENCEC, del Departamento Provincial de Farmacia y Ópticas, de la Empresa Comercializadora y Distribuidora de Medicamentos de Villa Clara y del CIM, así como de funcionarios de APS de Dirección Provincial de Salud y el Ministerio de Salud Pública. Dicho consenso tuvo lugar como parte de un Taller presencial de unificación de criterios.
Con las sugerencias y acuerdos emitidos en el Taller, se elaboró la tercera versión de los procedimientos, los cuales fueron enviados al Departamento de EC del CIM para su revisión y aprobación.
Etapa 4. Determinación de la aceptabilidad del sistema documental
Se elaboró un cuestionario (anexo) para evaluar la aceptabilidad de los documentos elaborados teniendo en cuenta aspectos de contenido, complejidad, confort, entrega y credibilidad.7 Dicho cuestionario fue del tipo escala de Likert de 7 puntos, donde el valor de 1 se corresponde con la menor puntuación (se evalúa como "Mal") y el valor 7 con la mejor puntuación (se evalúa de "Bien"). Este mismo cuestionario fue aplicado a investigadores de policlínicos involucrados en la conducción de EC y oncológicos en las provincias de La Habana, Villa Clara, Cienfuegos, Camagüey, Ciego de Ávila, Holguín, Santiago de Cuba y Guantánamo.
Se realizó un análisis estadístico de frecuencia con las variables evaluadas, por medio del paquete estadístico SPSS para Windows, versión 13,1.
RESULTADOS
Etapa 1. Determinación de las necesidades de documentación
Se elaboró el Mapa de Procesos para la conducción de EC oncológicos en la APS, quedaron definidos dos procesos estratégicos, seis operativos y dos de apoyo (Fig.).
Los procesos estratégicos identificados fueron la estrategia para la conducción de EC y la capacitación de recursos humanos. La gestión logística y gestión del capital humano fueron definidas como procesos de apoyo.
En el caso de los procesos operativos, se identificaron 13 subprocesos que se relacionan a continuación:
|
Proceso |
Subprocesos |
|
Apertura de EC |
1. Aprobación ética de la investigación |
|
Reclutamiento e inclusión de pacientes |
2. Reclutamiento de pacientes 3. Inclusión de pacientes |
|
Seguimiento, tratamiento y evaluación |
4. Investigador clínico 5. Enfermería |
|
Manejo de eventos adversos |
6. Detección 7. Tratamiento 8. Reporte |
|
Servicios de medios diagnósticos auxiliares |
9. Laboratorio clínico 10. Imagenología |
|
Monitoreo |
11. Preparación de la visita de monitoreo 12. Visita de monitoreo 13. Seguimiento de la visita |
Etapa 2. Diagnóstico de la situación de la documentación
La comparación de ambos sistemas de atención teniendo en cuenta las características de la conducción de EC permitió determinar diferencias que justifican la necesidad de elaborar un nuevo sistema documental para estandarizar los procesos en estas instituciones. Estos elementos se tuvieron en cuenta para definir los documentos que debían ser elaborados (Cuadro 1).
Por otra parte, se analizaron los 46 procedimientos de la Carpeta del Puesto de Trabajo del CIM. Se observó que de ellos, solo nueve contienen elementos aplicables al contexto de la APS, pero cuentan con un exceso de información en relación con algunos acápites y resultan insuficientes en otros.
Con relación al proceso de monitoreo, se determinó que esta actividad sería asumida por el CENCEC y se consideró que sus procedimientos sobre esta actividad resultaban suficientes para ser aplicados en el contexto de la atención primaria de salud.
Etapa 3. Elaboración de los documentos
Luego del análisis realizado, se elaboraron siete procedimientos normalizados de operaciones, tres instructivos y 10 registros (cuadro 2).
Los procedimientos elaborados, se encuentra disponibles de forma impresa en los 96 policlínicos que la actualidad incluyen pacientes en los ensayos clínicos desarrollados por el Centro de Inmunología Molecular en la APS. Las consultas médicas de cada institución (destinadas a ensayos clínicos), cuentan con un ejemplar que puede ser consultado por investigadores, auditores, inspectores o cualquier otro personal interesado. Su implementación contribuye a lograr la estandarización de los procesos en estas instituciones, así como a una mejor recolección y trazabilidad de los datos en estas investigaciones.
Etapa 4. Determinación de la aceptabilidad del sistema documental
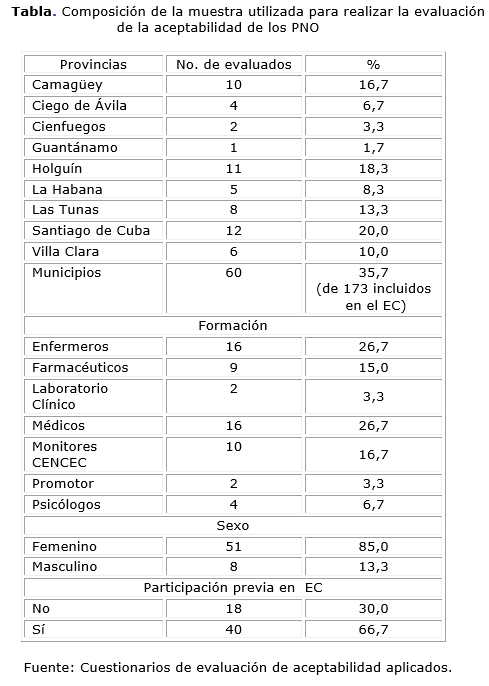
De los 80 cuestionarios distribuidos, se recibieron 59 respuestas (73 %). Las provincias más representadas fueron Santiago de Cuba (12,20 %), Holguín (11,18 %), Camagüey (10,17 %) y Las Tunas (8,13 %). La mayor parte de la muestra estuvo conformada por médicos (26,17 %), enfermeros (16,27 %) y monitores del CENCEC (10,17 %), con predominio del sexo femenino y con experiencia de trabajo previa en otros ensayos clínicos (tabla).
Se obtuvieron puntuaciones de 6,92 para las preguntas 1 y 2; 6,84 para la pregunta 3; 6,88 para las preguntas 4 y 5; 6, 94 y 6,98 para las preguntas 6 y 7 respectivamente. Todas estas puntuaciones medias son superiores a 6,80, que corresponden con evaluaciones muy cercanas a 7 (valor máximo de la escala) y se clasifican de "Bien".
DISCUSIÓN
Durante el año 2014 comenzó a gestarse el Sistema Documental para la conducción de ensayos clínicos oncológicos en la APS, con el objetivo de contribuir a garantizar la calidad de los estudios clínicos del CIM desarrollados en el nuevo escenario. Este sistema toma como base el sistema de BPC del CIM, el Sistema Documental de EC del Hospital "Celestino Hernández Robau"10 y el sistema de documentos utilizados por el MINSAP.7,8
Etapas 1 y 2. Determinación de las necesidades de documentación y diagnóstico de la situación de la documentación
La gestión por procesos es un sistema de trabajo enfocado a perseguir la mejora continua del funcionamiento de las actividades de una organización, mediante la identificación, la selección, la descripción, la documentación y la mejora de los procesos, donde los mapas de procesos constituyen herramientas para esquematizar estos.11
El mapa elaborado tiene como entrada el "Producto de Investigación no verificado clínicamente", porque la ejecución de EC en este escenario tiene entre sus objetivos el aporte de nuevos elementos para completar la evaluación clínica de productos en investigación, ya sea como parte de estudios de confirmación terapéutica (Fase III) o del uso terapéutico de estos en una población abierta, luego de obtenido su registro (Fase IV).2 Una vez que el producto es sometido a ensayo clínico, se obtienen como resultados datos clínicos que permiten avalar su seguridad y efectividad, por lo que el mapa tiene como salida el "Producto en investigación verificado clínicamente".
Está conformado por procesos estratégicos, operativos y de apoyo. Como procesos estratégicos se definieron la estrategia para la conducción de EC en la APS y la capacitación de recursos humanos, que permiten definir y desplegar las estrategias y objetivos de la organización.11
Los procesos operativos o claves, son aquellos que componen la cadena de valor de la organización, le añaden valor al cliente o inciden directamente en su satisfacción. Estos procesos del sistema resultan vitales e imprescindibles para el buen desempeño de las investigaciones (Fig.). Los procesos de apoyo, por su parte, sustentan logísticamente el resto del sistema.11
Este mapa de procesos resulta más abarcador que el contenido en dos sistemas documentales anteriormente elaborados en la provincia Villa Clara, los sistemas de gestión por procesos de EC oncológicos de los hospitales "Celestino Hernández Robau"10 y "Arnaldo Milián Castro",12 puesto que estos últimos fueron diseñados para la conducción de EC unicéntricos en dos instituciones con años de experiencia previa en la ejecución de estas investigaciones. Mientras, el nuevo sistema comprende la conducción de EC multicéntricos para ser llevados a cabo en todas las provincias del país, en instituciones con poca o ninguna experiencia en la ejecución de EC y abarca procesos en los cuales deben interactuar de forma coordinada instituciones de APS y ASS, lo cual implica una mayor complejidad del sistema diseñado. Por otra parte, se ofrece especial relevancia, a los procesos estratégicos, teniendo en cuenta que son estudios que comienzan a ser conducidos en el escenario de la APS y requieren de una estrategia diferenciada en cada provincia para lograr la preparación e incorporación de nuevos sitios a la conducción de EC, así como la adecuada capacitación previa del personal que garantice la calidad de los ensayos.
Etapa 3. Elaboración del sistema documental
La estrategia de trabajo definida estuvo encaminada a elaborar documentos que describieran las características de los procesos implicados en la conducción de EC, acorde a lo establecido en las regulaciones nacionales e internacionales que rigen la actividad.3-5 Se consideraron además, las características de las instituciones de la APS, de forma tal que el desarrollo de los procesos de EC estuvieran en armonía con aquellos que forman parte de la práctica médica habitual de estas instituciones. Para cumplir este objetivo cada documento fue elaborado de forma conjunta entre investigadores del centro promotor e investigadores de las instituciones de la APS y ASS, que es una de las singularidades de este trabajo. De igual forma, se tuvieron en cuenta las más recientes actualizaciones de las Normas ISO 9000 que sugieren eliminar el exceso de documentación y elaborar documentos más sencillos y prácticos.6
Se determinó que el Manual de Organización del Policlínico recoge de forma explícita los procedimientos que rigen el proceso de Medios Diagnósticos Auxiliares, en específico los Procedimientos de Imagenología y de Laboratorio Clínico, por lo que en este caso se consideró pertinente elaborar solo instructivos de trabajo y registros que complementaran esta información y respondieran a las especificidades del proceso en relación con los ensayos clínicos.
De igual forma se determinó que la Regulación No. 40 del Ministerio de Salud Pública (MINSAP) del año 2014, resultaba suficiente para organizar el funcionamiento de los comités de ética en estas instituciones de salud, por lo que no se consideró pertinente emitir un nuevo PNO para este proceso.10
A diferencia de los sistemas documentales antes mencionados,10,12 (que se encuentran conformados, en lo fundamental, por PNO y registros), el nuevo sistema incorpora la elaboración de instructivos para los procesos más sencillos que lo ameriten. Este hecho propicia que se cuente con un sistema que disminuye la complejidad de la documentación para facilitar su uso y consulta.6
Etapa 4. Determinación de la aceptabilidad del sistema documental
La selección de la muestra para el estudio de aceptabilidad se realizó teniendo en cuenta lograr un balance en el rango de perfiles profesionales, así como la representatividad de diferentes regiones del país.7
Los resultados indican que el sistema documental obtuvo calificaciones de "Bien" en las diferentes regiones del país, así como por diferentes tipos de profesionales y técnicos relacionados con la actividad. Este sistema fue elaborado por profesionales de la provincia Villa Clara, pero se realizó teniendo en cuenta la experiencia adquirida en EC previos ejecutados en diferentes provincias del país, a la vez que considera los requisitos regulatorios nacionales e internacionales como estándares para la ejecución de este tipo de investigaciones.
En resumen, las diferencias en la ejecución de los procesos de ensayos clínicos en instituciones de la APS con relación a la ASS, justifican la necesidad de implementar un nuevo sistema documental para estandarizar los procesos en este escenario. Los procedimientos elaborados mostraron buenos niveles de aceptabilidad entre los profesionales y técnicos encargados de su implementación y uso, lo cual favorece la futura estandarización de los procesos en instituciones de APS que conducen ensayos clínicos oncológicos, así como a una mejor recolección y trazabilidad de los datos en estas investigaciones.
De igual forma, el sistema documental contribuirá con el desarrollo de la capacitación dirigida a los recursos humanos y el aseguramiento de la calidad de los estudios clínicos llevados a cabo en este contexto, por lo que resulta importante la adecuada implementación del sistema documental en todos los policlínicos del país que conducen ensayo clínicos oncológicos.
Conflicto de
intereses
Los autores declaran que no presentan conflicto de intereses.
Participación de los autores
Fue justificada la contribución de cada autor participante.
REFERENCIAS BIBLIOGRÁFICAS
1. Aguilar Ríos A. Investigación clínica: clases de estudios y de ensayos clínicos. Metodología e interpretación. En: Martínez Nieto C. Ensayos clínicos en España: Ética, normativa y aspectos prácticos. Capítulo 2. Madrid: Master Line & Prodigio SL; 2010.
2. Laporte JR. El ensayo clínico controlado. En: Laporte JR, editor. Principios básicos de la investigación clínica. Capítulo 2. Madrid, España: Astra Zeneca; 2002. p. 8-24.
3. International Conference for Harmonization (ICH). Harmonized Guideline: Integral Addendum to ICH E6(R1) Guideline for Good Clinical Practice E6 (R2). [Internet]. 2015 jun 11 [cited 2016 Aug 16]. Available from: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E6/E6_R2__Addendum_Step2.pdf
4. OPS/OMS. Grupo de Trabajo de Buenas Prácticas Clínicas: Documento para las Américas. 2005. Perú; OPS. [citado 16 ago 2016]. Disponible en: http://apps.who.int/medicinedocs/documents/s18627es/s18627es.pdf
5. Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos. Resolución MINSAP 165. [Internet]. 2000 [actualizado 2011; citado 16 ago 2016]. Disponible en: http://www.cecmed.cu/sites/default/files/adjuntos/Reglamentacion/Res_MINSAP-165-00.pdf#overlay-context=reglamentacion/aprobadas%3Fpage%3D16
6. ISO 9001:2015 Documentación [Internet]. Blog9001: Escuela Europea de la Excelencia. 10 nov 2014 [citado 16 ago 2016]. Disponible en: http://www.nueva-iso-9001-2015.com/2014/11/iso-9001-documentacion/
7. Muñiz Roque A, Gandul Salabarría L, Pérez Charbonier C, Barceló Montiel Z, Fernández Corona BG, Presno MC, et al. Programa del médico y la enfermera de la familia. La Habana: ECIMED; 2011 [citado 3 oct 2016]. Disponible en: http://files.sld.cu/sida/files/2012/01/programa-medico-y-enfermera-2011-vigente.pdf
8. Ministerio de Salud Pública. Resolución Ministerial No. 40. La Habana: MINSAP; 2014.
9. Proctor E, Silmere H, Raghavan R, Hovmand P, Aarons G, Bunger A, et al. Outcomes for Implementation Research. Conceptual Distintions, Measurement Challenges, and Research Agenda. Adm Policy Ment Health. 2011;38:65-76.
10. Pérez K. Sistema de gestión por procesos de ensayos clínicos oncológicos. Deuschland, Alemania: Editorial académica Española; 2013.
11. Llanes-Font M, Isaac-Godínez CL, Moreno-Pino M, García-Vidal G. De la gestión por procesos a la gestión integrada por procesos. Ing Ind. 2014;35(3):6-8.
12. Ríos M, Díaz N, Hurtado A, Rodríguez CA. Sistema de gestión de los procesos de evaluación y tratamiento de los pacientes en ensayos clínicos. Acta Med Cent. 2015;9(2):[aprox. 16 p.].
Recibido: 18 de
diciembre de 2017.
Aprobado: 18 de febrero de 2018.
Geidy Lorenzo Monteagudo . Centro de Inmunología Molecular. Calle 15 esq. 216, Reparto Siboney, Playa, La Habana, Cuba.
Correo electrónico: geydi@cim.sld.cu
Anexo. Cuestionario de opinión sobre el "Sistema documental para la conducción de ensayos clínicos oncológicos en APS"
Estimado colega:
Ponemos a su disposición un Sistema Documental integrado por Procedimientos (PNO), Instructivos y Registros que permitan estandarizar los procesos de conducción de ensayos clínicos en las instituciones de la APS. Es nuestro interés conocer su opinión sobre estos documentos, por lo que le pedimos que complete el siguiente cuestionario. Para cada ítem deberá seleccionar un valor acorde a su opinión sobre la documentación en una escala del 1 al 7, donde 1 corresponde con la peor puntuación y 7 con la mejor. En caso de no tener criterio sobre algún ítem, seleccione NP (No procede).
Muchas gracias de antemano por su participación.
Provincia_____________________ Municipio__________________________
Formación: Médico____ Enfermería____ Farmacéutico____ Psicólogo____
Esp. Laboratorio Clínico____ Directivo____ Monitores____ Otros____ Sexo: F____ M____ Edad: _____
Ha participado en ensayos clínicos anteriores: Sí____ No____
|
Sobre el Sistema Documental responda: |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
NP |
||
|
1. Su contenido recoge los principales procesos de ensayos clínicos a ejecutar en instituciones de la APS |
Mal |
Bien |
||||||||
|
2. Su contenido
se encuentra acorde con las regulaciones nacionales e internacionales
que guían la actividad de ensayos clínicos |
Mal |
Bien |
||||||||
|
3. Los documentos y flujogramas de los procesos son de fácil compresión y propician que cada proceder pueda ser ejecutado adecuadamente |
Mal |
Bien |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
NP |
|||
|
4. El sistema documental es útil para facilitar la ejecución de los procesos que describe cada documento |
Mal |
Bien |
||||||||
|
5. Una persona
que se inicie en |
Mal |
Bien |
||||||||
|
6. Los procedimientos
de ensayos clínicos elaborados son de fácil implementación
como parte de |
Mal |
Bien |
||||||||
|
7. Los documentos
contribuyen a garantizar la calidad de los ensayos clínicos conducidos
|
Mal |
Bien |
Exprese cualquier otra opinión sobre los documentos.